Toxoplasmose : comprendre la résistance pour combattre la maladie
Publié par Cordelia Bisanz, le 16 mai 2014 4.5k
Au Laboratoire Adaptation et Pathogénie des Micro-organismes (LAPM) l’équipe autour de Marie-France Delauw et Pierre Cavaillès travaille sur un pathogène qui peut nous concerner tous : Toxoplasma gondii, l’agent causal de la toxoplasmose.
Toxoplasma gondii est un parasite cosmopolite qui se développe obligatoirement dans les cellules de l’individu infecté. La maladie est présente partout dans le monde, et on estime qu’un tiers de la population mondiale est infectée. L’homme s’infecte par l’ingestion de deux formes parasitaires distinctes, les kystes contenus dans les viandes parasitées ou les oocystes présents sur des légumes souillés par des fèces de chats infectés. Si l'infection est généralement bénigne, et même asymptomatique, elle présente des risques sérieux dans deux situations : l’infection congénitale en cas de primo-infection de la mère au cours de la grossesse (~ 1/1000 naissances), allant de l’avortement spontané à des graves lésions oculaires et cérébrales chez le nouveau-né, et la réactivation d’une infection latente qui est une cause importante de mortalité chez les personnes immunodéprimées (greffes d’organes, thérapies anti-cancéreuses, SIDA). Plus récemment, l’existence d’une séroprévalence toxoplasmique plus élevée parmi les patients atteints de troubles psychiatriques comme la schizophrénie et le trouble bipolaire, suggère que la toxoplasmose puisse être un facteur qui combiné à d’autres favoriserait la survenue de ces psychoses.
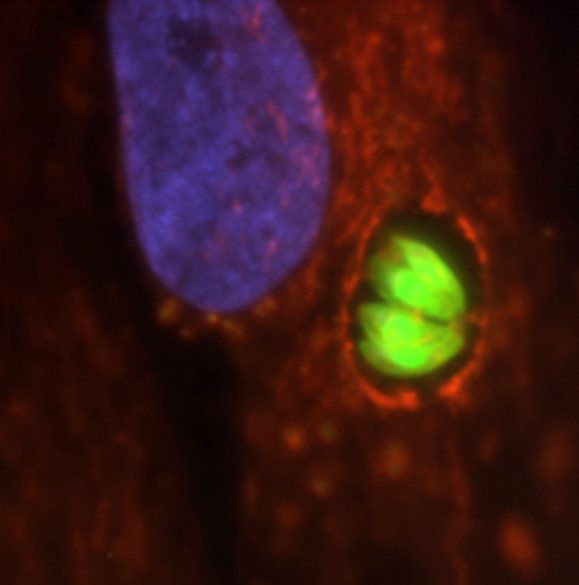
Les parasites (fluorescents, en vert) se multiplient dans leur cellule hôte dans un compartiment spécialisé, la vacuole parasitophore. En bleu : le noyau de la cellule hôte ; en rouge : les mitochondries de la cellule hôte qui se concentrent autour de la vacuole du parasite.
Avancées grâce au modèle expérimental du rat LEWIS
Jusqu’à ce jour, les pistes de recherche pour la mise au point de nouveaux médicaments contre cette maladie parasitaire concernaient essentiellement l’agent pathogène. Les travaux publiés dans la revue PloS Pathogens par un groupe de chercheurs grenoblois et toulousains ouvrent la voie à une approche radicalement différente et ont été initiés suite à la découverte d’une souche de rat, le rat Lewis (LEW), totalement réfractaire à l’infection (sérologie anti-toxoplasmique négative, absence de kystes parasitaires dans le cerveau). Partant du principe que l’immunité naturelle et la résistance aux pathogènes met en jeu des spécificités génétiques de l’hôte, ces chercheurs avaient localisé la région du génome responsable de la résistance à la toxoplasmose chez le rat LEW. Située sur le chromosome 10, cette région - appelée locus Toxo1 – contrôle la dissémination du parasite au niveau de la barrière intestinale, site de pénétration du parasite dans l’organisme. A noter également que cette région Toxo1 existe chez l’Homme.
Une nouvelle approche génétique, appelée étude haplotypique, a consisté à décrypter plus finement l’organisation du locus Toxo1, et a permis de circonscrire la région responsable de la résistance au parasite à un ensemble de 29 gènes. L’analyse de la séquence de ces gènes chez des rats résistants ou susceptibles, a mis en évidence l’existence de marqueurs génétiques systématiquement liés à la résistance, indiquant que la résistance à la toxoplasmose peut être prédite. Parmi eux, le gène codant pour NLRP1a, un senseur intracellulaire de l’immunité innée, qui reconnait des pathogènes à l’intérieur des cellules et déclenche des mesures de protection de l’organisme en cas d’invasion. NLRP1a appartient à un complexe appelé inflammasome, connu pour déclencher une forme de mort cellulaire programmée (pyroptose) et mettre en jeu une protéase, la caspase-1.
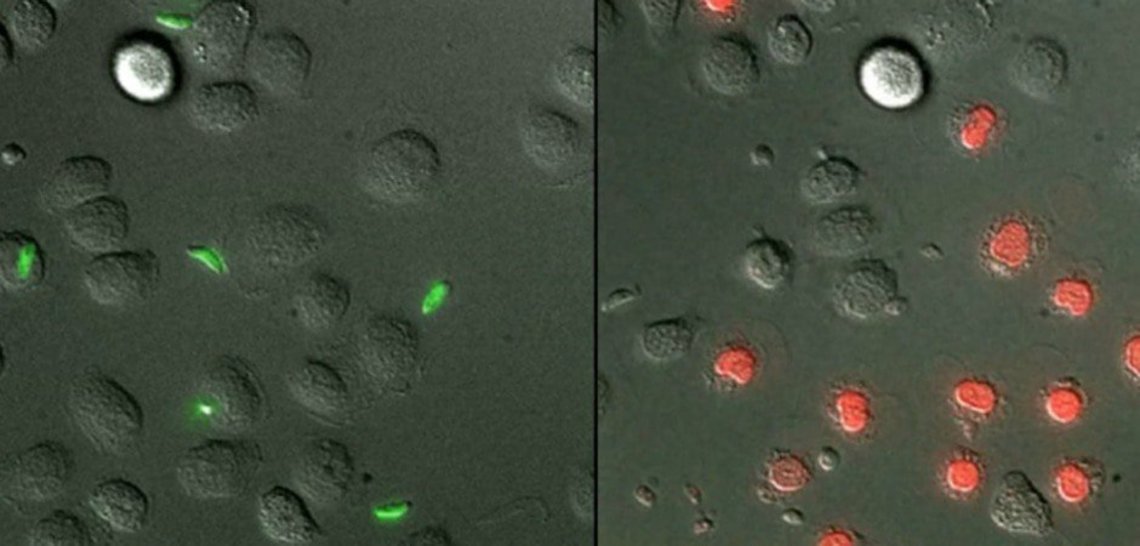
Les chercheurs ont pu montrer que la résistance au parasite chez le rat LEW était associée à l’induction de mort des macrophages infectés et des parasites intracellulaires (cf Figures). Cette mort cellulaire est très rapide et présente tous les aspects d’une pyroptose (production d’espèces radicalaires de l’oxygène, activation de la caspase-1, sécrétion d’interleukine 1-β). Les chercheurs ont alors utilisé des inhibiteurs pour bloquer l’activation de la caspase-1 et ont montré l’absence de mort des parasites et des macrophages, confirmant l’implication de l’inflammasome.
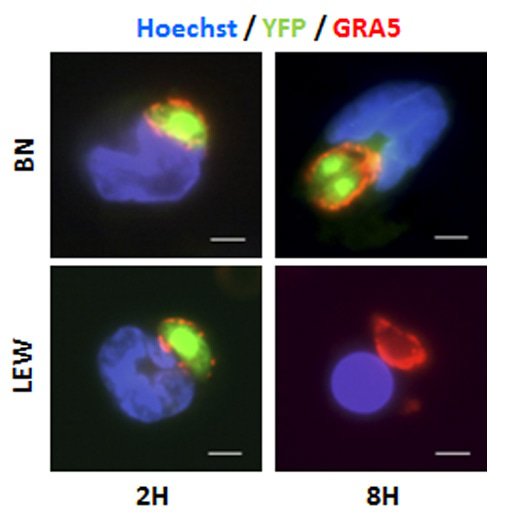
Les parasites fluorescents (en vert, YFP) infectent les macrophages des rats BN et LEW de la même manière (2H). Après 8 heures le parasite se multiplie uniquement dans les macrophages BN, alors que les macrophages LEW et leurs parasites meurent. En bleu : les noyaux des macrophages, en rouge : la vacuole parasitophore dans lesquelles les parasites se multiplient.
Vers l'identification d'un mécanisme majeur de l'immunité innée
Ces données représentent de nouvelles perspectives vers l'identification d'un mécanisme majeur de l'immunité innée qui protège contre la toxoplasmose. La découverte du gène (ou des gènes) impliqué(s) dans la résistance à l’infection pourrait permettre le développement d’outils pour la prévention de la toxoplasmose tant en médecine humaine que vétérinaire (identification d’individus naturellement résistants et stratégies thérapeutiques).
>> Pour aller plus loin :
- Sergent et al., 2005. Infect. Immun. 73, 6990-6997.
- Cavaillès et al., 2006. Proc. Natl. Acad. Sci. USA 103, 744-749.
- Cavaillès et al., 2014. PlosPath.April 03, DOI: 10.1371/journal.ppat.1004005
- http://www.anses.fr/Documents/MIC-Fi-Toxoplasma.pdf