L’hélium : la précieuse clé vers le monde du froid
Publié par Timothée Vasina, le 28 juin 2023 8.1k
Au moment où vous lisez ces mots, les scientifiques de laboratoires du monde entier, et notamment à Grenoble, étudient le comportement de la matière à des températures plus basses que n’importe où ailleurs dans l’Univers.
L’hélium : la précieuse clé vers le monde du froid
Au moment où vous lisez ces mots, les scientifiques de laboratoires du monde entier, et notamment à Grenoble, étudient le comportement de la matière à des températures plus basses que n’importe où ailleurs dans l’Univers.
Si d’aventure vous vous trouvez dans un laboratoire de physique des matériaux (comme sur la Presqu’Île de Grenoble, à l’Institut Néel par exemple), vous remarquerez sans doute, entre deux chercheurs débordés, un outil singulier. De grandes bonbonnes sur roulettes, des tuyaux bardés de vannes partant dans tous les sens, des enchevêtrements de câbles … Pas de doute, vous êtes devant un cryostat ! Cet outil permet d’atteindre des températures de moins de 1 Kelvin (donc plus froid que le vide intersidéral !) afin d’extraire les secrets de la matière. S’il s’agit d’instruments d’une grande complexité, vous serez peut-être étonnés d’apprendre que le fonctionnement des cryostats repose sur un gaz bien connu : l’hélium.
L’hélium et son cousin
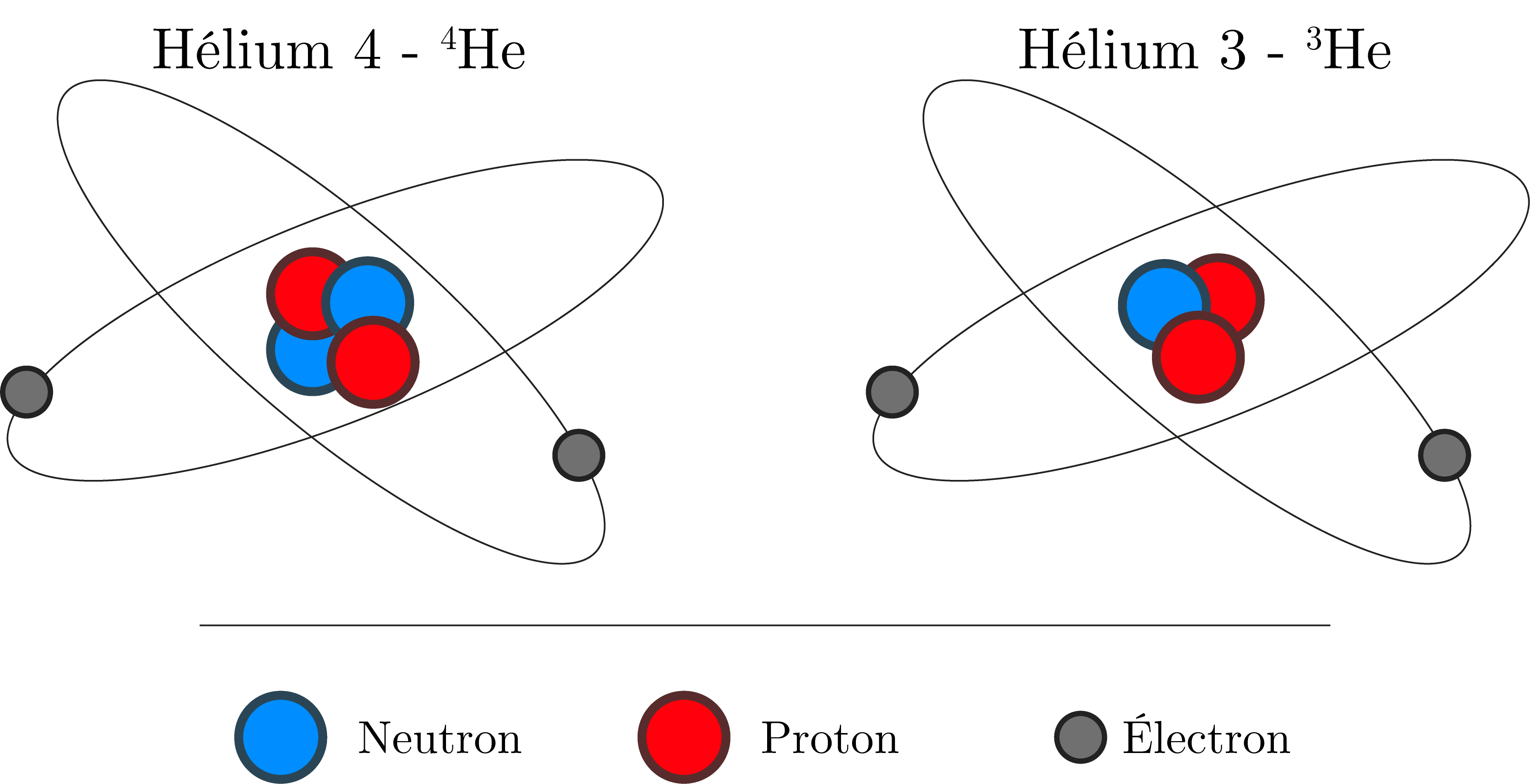
L’hélium, de symbole He, est le deuxième atome le plus abondant dans l’Univers après l’hydrogène. Il existe sous deux formes stables : l’hélium 4 et l’hélium 3 (cf. image), on parle d’isotopes. Ce dernier, possédant un neutron de moins que l’hélium 4, est beaucoup plus rare à l’état naturel ! Dans l’atmosphère terrestre, seulement 1/1 000 000 des atomes d’hélium est un isotope 3He.
La course du froid
Le froid est utilisé depuis toujours pour la conservation des aliments, mais les progrès réalisés en thermodynamique lors de la révolution industrielle ont poussé les chercheurs à explorer les limites du froid : jusqu’à quel point peut-on refroidir un système ? Au cours du XIXe siècle, les espèces gazeuses comme l’oxygène, l’azote, puis l’hydrogène seront ainsi toutes successivement liquéfiées en laboratoire.
Toutes ? Non ! Un petit atome résiste encore et toujours à l'envahisseur : l’hélium ! Il faudra attendre les travaux du néerlandais H. K. Onnes pour réussir à le liquéfier en 1908, et par la même définitivement sonner le glas de la grande course du froid.

Contrairement à tous les autres éléments chimiques, l’hélium ne se solidifie jamais en refroidissant à pression ambiante. D’une température de 4,2 K, l’hélium est en fait le liquide le plus froid que l’on puisse obtenir à l’aide d’un corps pur refroidi.
Mais donc comment procèdent les laboratoires du monde entier pour atteindre des températures encore inférieures à 4,2 K ? La réponse se trouve dans le fait que l’hélium existe sous forme de deux isotopes.
3He – 4He, un cocktail complétement givré
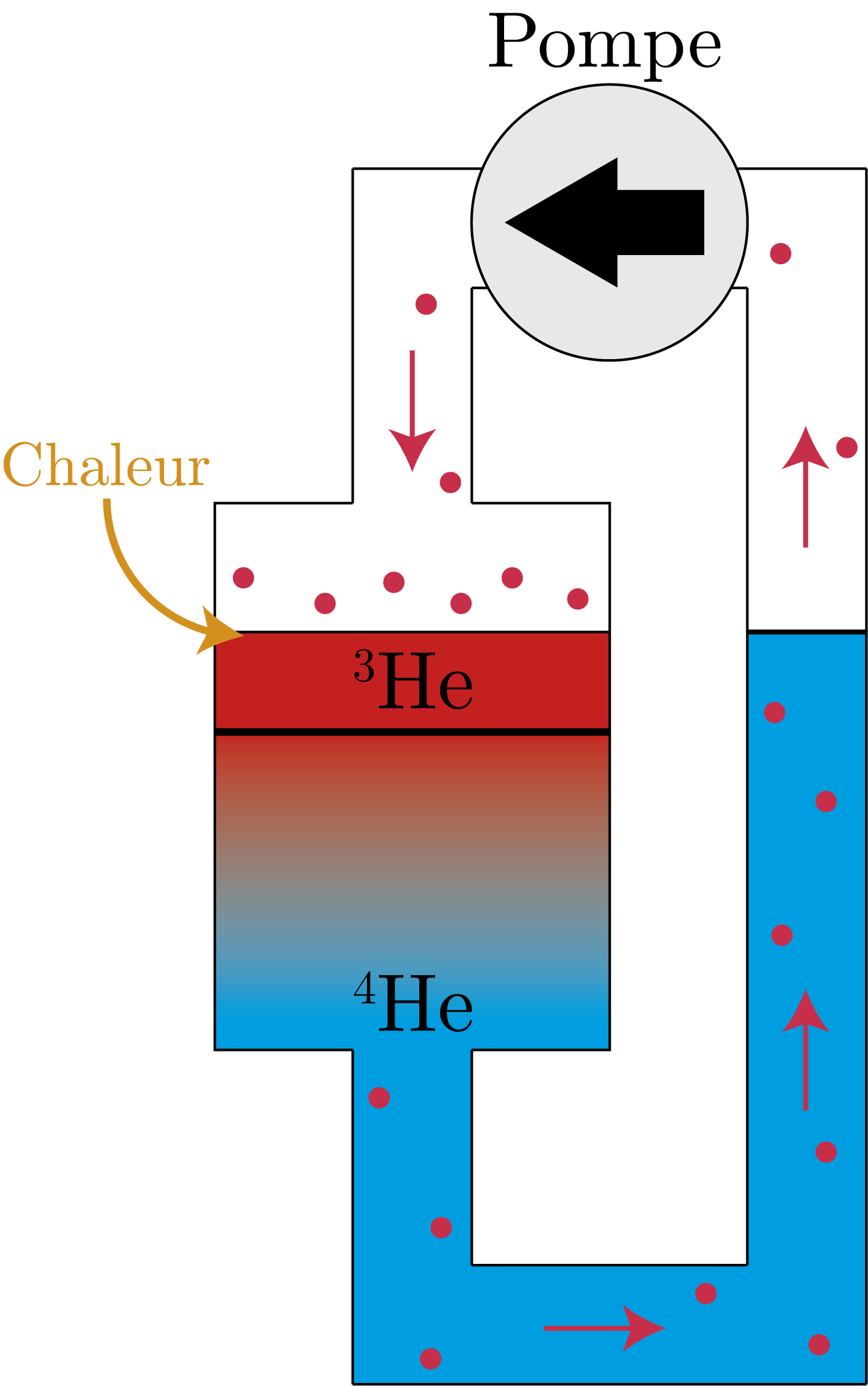
Pour refroidir un système à des températures proches du zéro absolu, procéder en le mettant en contact avec une substance plus froide n’est plus vraiment possible. Il faut donc ruser afin de retirer de l’énergie supplémentaire au système, et la solution vient d’une propriété des deux isotopes d’hélium. Les outils utilisant ces propriétés sont appelés cryostats à dilution.
Lorsque 3He et 4He sont mis en contact, 3He peut se diluer légèrement dans la phase de 4He, à hauteur d’environ 6 %. Ce phénomène de dilution (on parle aussi de « mélange ») est un processus endothermique, autrement dit il vole de la chaleur à son environnement pour se produire. Maintenant il est possible (avec une pompe) d’enlever un peu de 3He de la phase diluée, et le réinjecter de l’autre côté dans la phase 3He pur. Mais l’équilibre a été rompu : pour réobtenir cet équilibre de 6 %, 3He va se diluer à nouveau dans 4He. Le circuit pompant en permanence de la chaleur, nous avons créé un véritable réfrigérateur à hélium ! (cf. image)
Petit mais précieux
Vous l’aurez compris, l’hélium est la clé de voûte de nombreux systèmes cryogéniques. De l’informatique quantique au fonctionnement des IRM en passant par la cryoconservation, les applications des systèmes ultra-froids sont variées. Malheureusement, l’hélium est condamné à s’envoler dans l’atmosphère lorsqu’il est relâché, et devient donc inaccessible.
Aujourd’hui les laboratoires tout autour du globe ont adapté leur consommation face à la pénurie mondiale d’hélium et à son prix grandissant, notamment en essayant de conserver les vapeurs et d’en tirer un maximum de rendement thermique. Alors la prochaine fois que vous croiserez un ballon d’hélium dans la rue, ayez une pensée pour cette denrée précieuse qui s’envolera, à jamais hors d’atteinte ; peut-être y verrez-vous, je l’espère, bien plus qu’un gaz comme les autres.
[Photo de couverture : Cryostat à dilution, Laboratoire PHELIQS, CEA Grenoble]

