CRISPR-CAS, le couteau suisse génétique
Publié par Hoby Ranarison, le 8 octobre 2020 4.1k
Vous en avez peut être entendu parler ces dernières années, certains la décrivent comme l’innovation majeure du XXIè siècle en biotechnologies : le système “Clustered Regularly Interspaced Short Palindromic Repeats”, traduit en français par “Courtes Répétitions Palindromiques Groupées et Régulièrement Espacées » est depuis peu le nouveau fleuron du secteur de la biotechnologie biomédicale mais pas seulement. Malgré la complexité évidente de ces termes, retenez simplement que le système CRISPR permet de modifier le génome, qu’il soit humain, végétal ou bactérien. A l’heure où les travaux en recherche médicale sont pour la plupart tournés vers l’épigénétique, c’est-à-dire vers l’étude des variations d’activités de nos gènes, la découverte du système CRISPR apparaît comme une véritable révolution pour la communauté scientifique, qui voit au travers de ce mécanisme, une avancée historique dans l’étude du génome humain, mais également dans ses applications pratiques, qui permettraient de mettre cette technique au service des thérapies géniques pour des maladies génétiques ou encore dans le traitement des cancers. Mais comment et à partir de quel(s) élément(s) fonctionne ce système, en quoi ouvre-t-il des perspectives sur l’évolution de notre espèce, qu’en est-il des applications mais aussi des conséquences ? Autant de questions gravitant autour de CRISPR, qui, pour le moment nous livre plus de questions que de réponses à l’heure actuelle.
CRISPR-Cas : les règles du jeu
Avant toute chose, un peu d’histoire. C’est en 2012 que le système CRISPR voit le jour, à l’université de Berkeley en Californie aux Etats-Unis. A l’origine de cette découverte, et on peut en être fier, deux scientifiques, Emmanuelle Charpentier, biochimiste et généticienne française et sa collègue Jennifer Doudna, maître de conférence en biologie moléculaire à l’université de Berkeley, tout juste récompensées par le Nobel de Chimie 2020.

Emmanuelle Charpentier (à gauche) et Jennifer Doudna (à droite)
Mais en réalité, ce mécanisme existe depuis bien plus longtemps, puisqu’il s’agit d’un phénomène naturel immunitaire présent dans les bactéries pour lutter contre les virus. Lorsqu’une bactérie se retrouve infectée par un virus, ce mécanisme immunitaire se met en place, permettant l’élimination du virus.
Imaginez que vous êtes infectés par un virus. Pourquoi un virus spécifiquement ? Tout simplement parce que cet agent infectieux possède la particularité d’avoir son propre génome. Vous le contractez par contact avec une surface quelconque ou par l’air que vous respirez. Le virus pénètre ensuite dans votre organisme et y injecte son propre génome à l’intérieur des cellules. S’en suit une phase de réplication, exactement identique au processus naturel qui aboutit à la production de nouvelles cellules virales.
Le système CRISPR se met en place à partir du moment où de l’ADN viral est injecté dans une cellule. Ce système est divisé en deux parties fonctionnelles, CRISPR d’un côté et Cas de l’autre. La première, CRISPR, a la capacité de reconnaître un ADN exogène à l’espèce en question, c’est-à-dire un ADN étranger à un organisme, celui du virus. Ce génome étranger est donc reconnu par le système CRISPR qui va ensuite le transférer vers la deuxième partie fonctionnelle du système, le système cas. Cas possède quant à lui la capacité de découper l’ADN, qui est donc dégradé en plusieurs morceaux. On dit qu’il s’agit d’une enzyme, que l’on peut nommer « enzyme cas ». Voilà pourquoi les scientifiques parlent de CRISPR-Cas, deux éléments réunis dans un même système, que l’on qualifie de « complexe » en biologie moléculaire. La partie de l’ADN contaminée par le virus a donc été éliminée et la réparation par de l’ADN propre à l’organisme est reproduite, c’est la phase de réparation. Cependant, dans cette même étape, on peut aujourd’hui remplacer cet ADN par de l’ADN étranger, c’est-à-dire qu’il est programmé à l’avance en laboratoire, et l’intégrer au génome, mais nous y reviendrons après. Ce complexe CRISPR-Cas se déplace ainsi tout le long de l’ADN, comme s’il effectuait un scanner, pour détecter des anomalies. Lorsque le complexe détecte un problème sur l’ADN, on dit que CRISPR-Cas « coupe » la partie d’ADN présentant un défaut, à la manière d’un ciseau. Voilà pourquoi on parle de « ciseaux moléculaires » pour CRISPR-Cas.
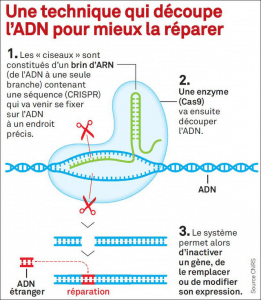
Dans CRISPR-Cas9, pourquoi Cas9 ?
Sachez qu’il existe plusieurs enzymes Cas. Chacune possède sa spécificité. Cas9 a la particularité de couper l’ADN sur chaque brin, soit deux coupes, l’ADN étant constitué de deux brins distincts. Cas9 est aujourd’hui l’enzyme cas la plus connue et maîtrisée. Mais d’autres existent, comme Cas13, qui a la même finalité, c’est-à-dire corriger des anomalies génétiques, mais sur l’ARN uniquement. En conséquence, Cas13 ne coupe pas l’ADN.
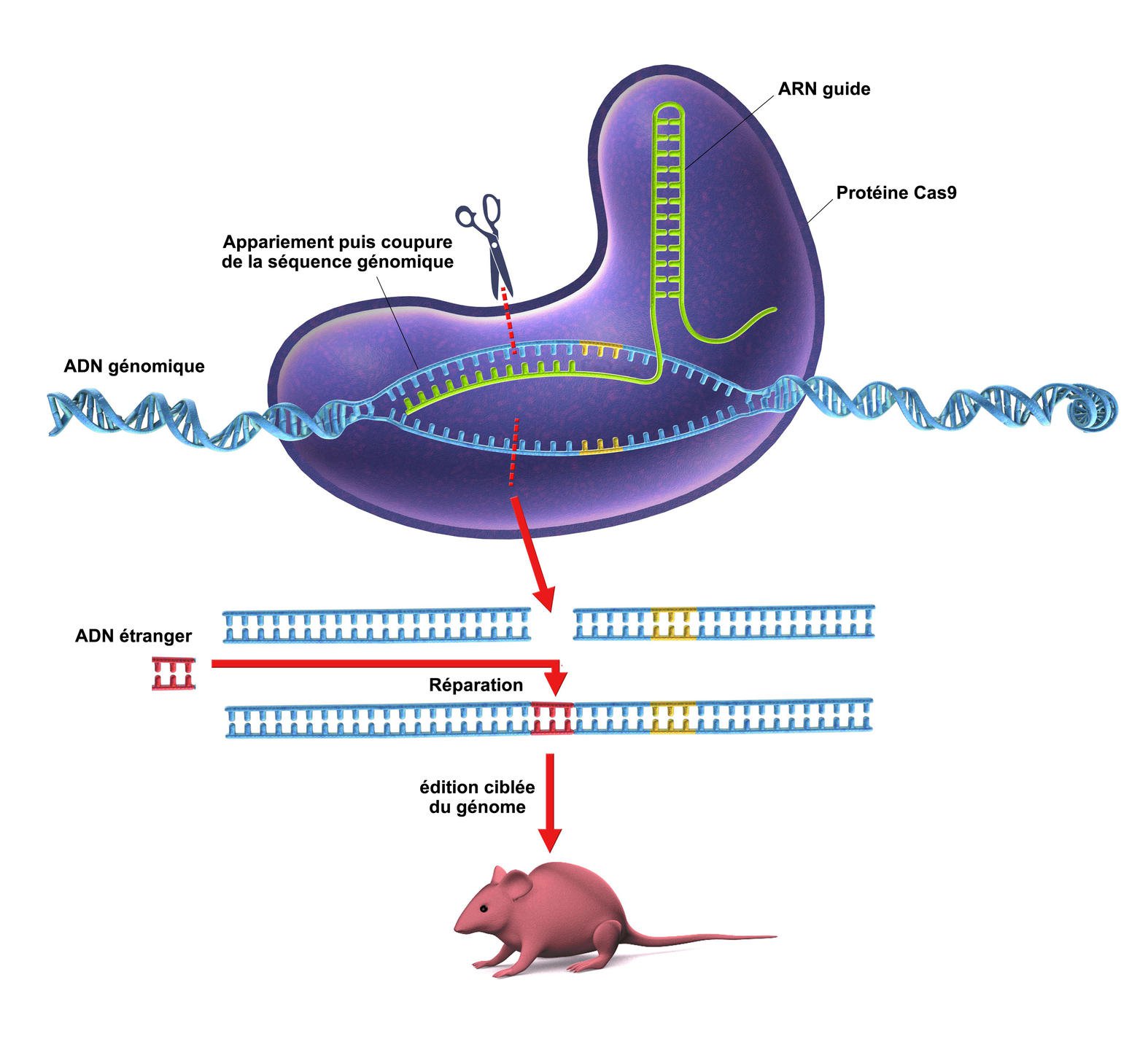
Réussir à programmer ce système pour couper l’ADN à un endroit précis mais sur un génome humain, animal et végétal, c’est la prouesse scientifique du XXIè siècle réalisée par les scientifiques. Lorsque CRISPR-Cas9 coupe l’ADN, la cellule se répare en générant un autre morceau d’ADN, identique à celui disparu, pour éviter de rentrer en apoptose, qui est le processus de mort cellulaire. En conséquence, il est maintenant possible d’insérer ou de retirer une mutation dans un génome, sur la nouvelle séquence dite réparatrice d’ADN. Cela revient donc à effectuer de la programmation moléculaire génétique, jusqu’ici impossible à pratiquer et totalement méconnu au sein de la communauté scientifique, qui qualifie ainsi cet outil de révolutionnaire.
La ligne à ne pas franchir, faites entrer l’accusé !

He Jiankui, lors d’une conférence internationale
Une découverte d’une telle ampleur crée forcément un engouement massif dans la communauté scientifique. Certains ont par exemple franchi la ligne avant même qu’elle ne soit tracée. C’est le cas de He Jiankui, chercheur en biophysique à l’université de Shenzen en Chine. Ce scientifique est à l’origine des deux premiers bébés génétiquement modifiés en 2018. L’idée du scientifique était d’exposer les embryons sains des nouveaux nés aux mécanismes CRISPR-Cas9 dans le but de les rendre résistantes aux virus du sida, le VIH, dont le père était séropositif. Cette expérience a été très mal accueillie dans la communauté scientifique et jugée comme purement améliorative et augmentative compte tenu du fait que les bébés ne risquaient pas d’attraper le virus. Également, le biophysicien semble avoir effectuer ses travaux sans concertation avec la communauté scientifique dans le plus grand des secrets, mais aussi sans publications de ses expériences préliminaires. Depuis, le chercheur a été condamné à trois ans de prison ferme ainsi qu’à près de 400 000 euros d’amende par le tribunal de Shenzen.
Cette affaire soulève bien entendu l’aspect éthique de l’application de CRISPR-Cas9. Si d’autres expériences de ce genre continuent à être pratiquées, à termes, pourrait avoir lieu l’émergence des bébés dits « sur commande », c’est-à-dire la programmation d’un individu souhaité, suivant ses attributs phénotypiques (physiques), tels que la couleur des yeux, le nez, la couleur de peau, etc, mais également des expériences pratiquées sur des adultes dans le but d’améliorer leurs performances sportives par exemple. En effet, le champ d’action de CRISPR-Cas9 est purement stratégique. Agissant à l’échelle de l’ADN, celui-ci contient les gènes définissant les fonctions des cellules qui constituent les tissus, à l’origine des muscles et donc de l’organisme.
CRISPR-Cas, l’avenir en ligne de mire
Malgré tout, en vue d’une application relativement plus maîtrisée et encadrée, CRISPR-Cas suscite une immense réjouissance de la part des généticiens médicaux ainsi que des médecins. Car c’est en cancérologie que CRISPR-Cas9 pourrait jouer un rôle majeur à l’avenir, peut-être même dès maintenant. Des chercheurs américains se sont concentrés sur l’immunothérapie, très utilisée dans le traitement de plusieurs types de cancers. Ce type de thérapie consiste à administrer au patient des anticorps spécifiques à un cancer. Les scientifiques américains se sont donc penchés sur les propriétés immunologiques de CRISPR-Cas9. Pour cela, deux femmes et un homme atteints d’un cancer ont été choisis. Pour les scientifiques, le but est simple : modifier l’immunité du patient grâce au système CRISPR-Cas9 afin de voir si ce dernier a une influence sur la prolifération du cancer. Les chercheurs ont donc prélevé les lymphocytes (globules blancs) des cobayes, acteurs majeurs de l’immunité, pour les soumettre à CRISPR-Cas9. A ce stade, le patient voit ses cellules immunitaires modifiées, car les gènes, au contact de CRISPR-Cas9, des lymphocytes qui reconnaissent les cellules cancéreuses ont été reprogrammés. Les globules blancs ont donc été génétiquement modifiés puis réadministrés aux patients. Quelques mois plus tard, il a été constaté que les lymphocytes étaient toujours présents. Cette expérience prouve que CRISPR-Cas a la capacité d’aider le système immunitaire à reconnaître les cellules cancéreuses. Cependant, cette étude ne peut être encore en mesure de confirmer si CRISPR-Cas est en mesure de traiter efficacement les cancers.
Si CRISPR-Cas se révèle être l’outil primordial dans le domaine de la santé, il l’est également dans celui de l’agroalimentaire. La production de denrées génétiquement modifiées n’est pas chose nouvelle dans ce secteur mais avec l’apparition de ce nouveau système, les industries du secteur y gagnent en temps, main d’œuvre et coût. Malheureusement, la communauté scientifique craint que cela ne mène encore à d’autres dérives, notamment sur la question du « gene drive », qui se résume à amplifier un gène d’un organisme mais qui à terme dérègle l’écosystème. Les céréales, mais aussi fruits et légumes se retrouvent donc en première ligne, plus que jamais, face aux innovations biotechnologiques.
Programmer, supprimer ou modifier une portion d’ADN en laboratoire, oui, l’humain est donc en passe de réaliser une première dans l’histoire de la vie en devenant la première espèce à modifier son propre génome. Le système CRISPR-Cas, méconnu de la communauté scientifique il y a encore une vingtaine d’années, ne fait pas simplement que redéfinir ou révolutionner la biologie moléculaire, mais bien plus. Dépassant le domaine de la santé, ce sont d’autres secteurs qui en profitent également. Du fait de sa relative simplicité au niveau de son mécanisme, l’outil est devenu très rapidement une source d’enjeux, de fantasmes voire d’excès, jouant sur le terrain de l’éthique et du transhumanisme.
Si cet outil s’étend à autant de champs disciplinaires et couvre autant de questions qui soulèveront inévitablement le lien entre science, éthique et société, on peut se dire que CRISPR-Cas semble donc avoir de beaux jours devant lui, mais à quel prix …
Hoby Ranarison





