Recherche, industrie, informatique : LADI, ou comment booster la biologie structurale aux neutrons (8/12 - 2021)
Publié par ACONIT (Association pour un Conservatoire de l'Informatique et de la Télématique), le 15 juillet 2021 1.8k
par Alain Filhol, Computer Scientist, Institut Laue-Langevin (ILL)
Les incroyables progrès de la biologie ces 70 dernières années tiennent au fait qu'on sait enfin "voir" la structure des protéines et enzymes, ces molécules qui sont au coeur du vivant ou d'agents pathogènes comme les virus et les prions. Autrement dit, on peut observer la forme de ces énormes molécules (appelées macromolécules), la nature des constituants qui leur confèrent leur pouvoir bénéfique (vie cellulaire) ou maléfique (maladies), ainsi que leurs assemblages. Depuis la découverte de la structure de l'ADN (Crick, Watson, Wilkins et Franklin, 1952), puis de l'hémoglobine (Kendrew et col., 1958) obtenues par diffraction des rayons X, les progrès ont d'abord été lents (générateurs X trop peu puissants) puis extrêmement rapides grâce aux très intenses sources synchrotron.
Neutrons contre rayons X
En comparaison de la luminosité de millions de soleils des synchrotrons, les meilleures sources de neutrons ne sont que de pâles bougies. Alors, en quoi pouvaient-elles rivaliser avec eux ?
En fait, si les synchrotrons produisent des déterminations de structures biologiques à un rythme quasi industriel, ils voient surtout le "squelette" carboné de ces molécules et beaucoup moins bien leur "chair" hydrogénée et/ou leurs "habits" de molécules d'eau. Or c'est à ce niveau que se trouvent les "sites actifs", les lieux très précis où se passent les réactions chimiques entre molécules et avec les médicaments. C'est donc là qu'il faut regarder pour comprendre les phénomènes mis en jeu.
Il se trouve que les neutrons sont particulièrement efficace pour "voir" l'hydrogène et les molécules d'eau et, de ce fait, ils peuvent apporter des informations cruciales. La difficulté, avant LADI, était que la mesure de la structure d'une seule de ces macromolécules pouvait prendre des mois avec un diffractomètre à neutrons classique et, le plus souvent, nécessitait de gros cristaux quasi impossibles à obtenir. Le handicap était donc énorme car, sur un synchrotron, on peut effectuer la mesure en seulement un ou deux jours et à partir de cristaux minuscules.
Mais comment compenser ce handicap ?
LADI a été développé en 1995 à Grenoble par l'EMBL et l'ILL [1]. C'est le premier diffractomètre à neutrons ayant permis la mesure de la structure de protéines en une dizaine de jours seulement (environ 100 fois plus vite que les instruments concurrents de l'époque) et à partir de cristaux bien plus petits qu'avant. LADI, maintenant retraité, a ouvert la voie à LADI II, KOALA, LADI III, DALI, etc., qui produisent des résultats remarquables et très complémentaires par rapport à ceux des synchrotrons. Il est à noter que ce type d'appareil est également fort utile pour l'étude des transitions de phase de matériaux magnétiques ou autres (par ex. instrument VIVALDI), mais ce point ne sera pas développé ici.

- A gauche : Une vue d'ensemble de LADI (les neutrons arrivent de l'arrière).
- A droite : Mise en place d'un échantillon, ©1998 ILL, Grenoble, France.
(pour voir l'animation, cliquer sur le lien, ©2003 iMediaSoft et ILL).
Mais où est l'astuce ?
LADI est un diffactomètre Laue, une technique de mesure utilisée partout dans le monde et nommée ainsi en l'honneur de la célèbre expérience de Max von Laue (1912) qui a fondé la cristallographie. Rien de plus simple : on envoie un faisceau blanc de rayons X (faisceau polychromatique) sur un cristal échantillon entouré d'un film photo. Le cristal disperse (diffracte) alors le faisceau en tous sens comme la boule à facettes des boîtes de nuit et le film enregistre une multitude de taches qui sont la signature de la structure interne de l'échantillon et des molécules qui le composent. En effet, les intensités des taches de diffraction révèlent la nature des atomes et les distances entre les taches fournissent les distances entre les atomes.
L'astuce qui a tout changé aura été d'utiliser comme détecteur pour LADI une "plaque-image" adaptée aux neutrons en lieu et place d'un film photo. Une fois celle-ci impressionnée par les neutrons, l'image est révélée, sans démontage ni bain chimique, par le balayage d'un premier laser, puis effacée par un second. Ceci fournit des données digitales d'une qualité bien supérieure à celle des films photos si difficiles à utiliser pour des mesures quantitatives. En outre, ce design innovant permet l'enchainement de séquences "orientation de l'échantillon > exposition aux neutrons > lecture des données > effacement de la plaque image", de façon totalement automatique, jusqu'à l'obtention de la mesure complète [2].
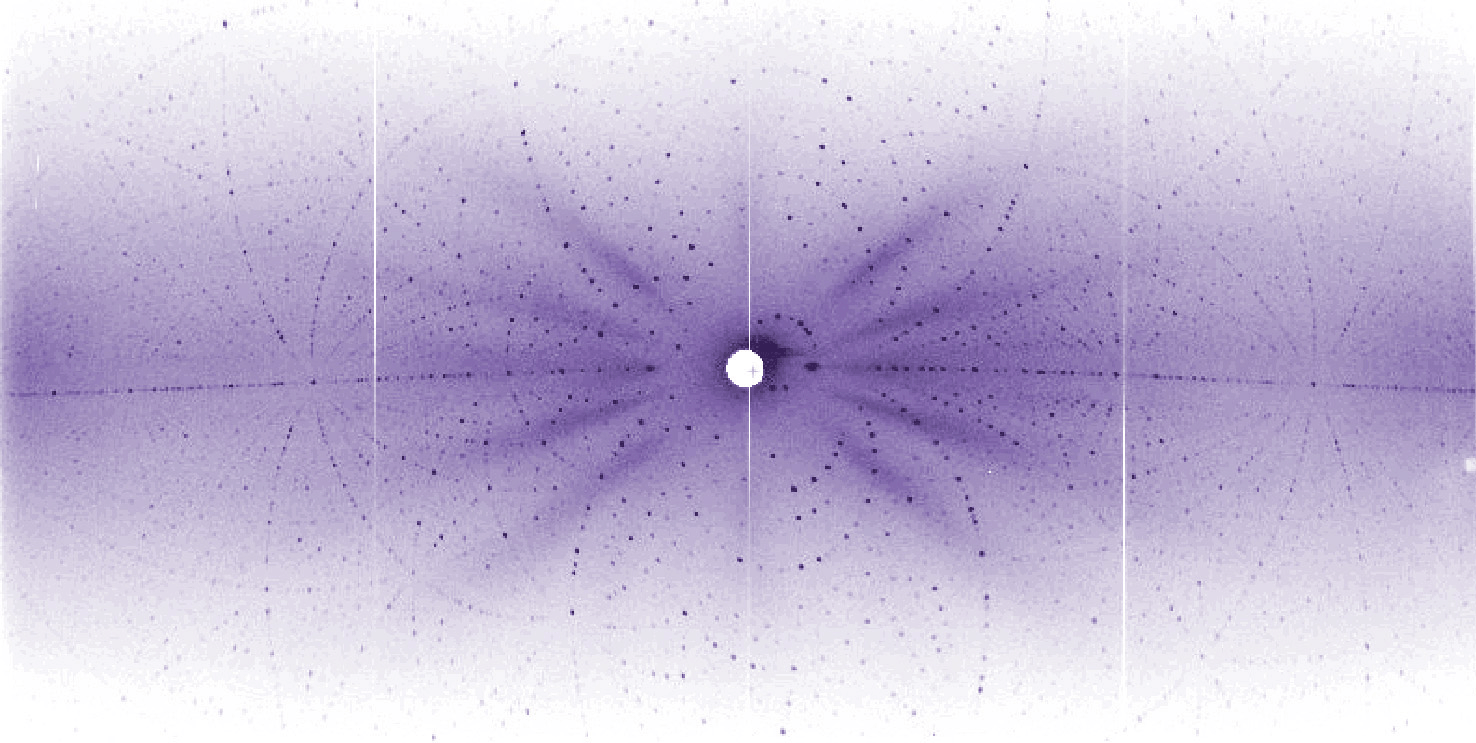
- Diagramme de diffraction aux neutrons d'un cristal de vitamine B12, tel qu'enregistré par LADI,©2003 ILL, Grenoble, France.
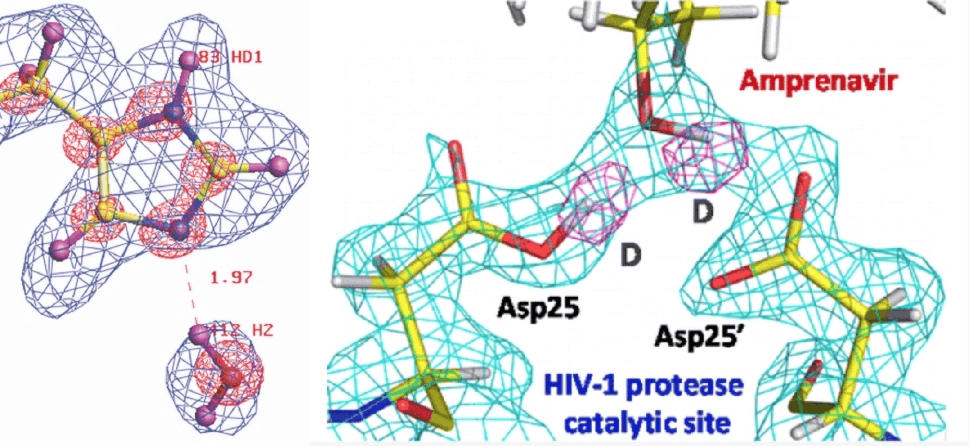
- A gauche : Une molécule d'eau liée à l'atome d'une enzyme telle que la voit LADI dès 2003, ©2003 ILL, Grenoble, France
- A droite : Observation de l'interaction d'un inhibiteur avec le HIV-1 (référence : ©2013 DOI: 10.1021/jm400684f)
Pourquoi mesurer aux neutrons ?
Nous avons déjà dit que les neutrons voient particulièrement bien les atomes d'hydrogène alors que les rayons X les voient difficilement. C'est déjà un argument fort puisque près de la moitié des atomes d'une molécule biologique sont des atomes d'hydrogène et parce que l'essentiel des réactions chimiques qui expliquent une fonction biologique donnée ou l'action d'un médicament, sont soit des "liaisons hydrogène", soit des liaisons entre deux atomes via un atome d'hydrogène.
Mais il y a plus fort. Les neutrons voient de façon totalement différente l'atome d'hydrogène normal H et son isotope le deutérium D. Les biologistes peuvent alors, à loisir, remplacer tout ou partie des hydrogènes H par des deutérium D sans altérer la molécule à étudier. En jouant malin, il est alors possible de faire ressortir de la foule les quelques atomes essentiels qui, sans cela, resteraient masqués à la mesure.
Pour expliquer les succès de LADI et de sa descendance, il faudrait expliquer certain des très complexes mécanismes biologiques rarement connus du grand public. Nous ne citerons donc ici que l'étude de l'action d'un inhibiteur sur le mécanisme de fixation d'un anti-rétrovirus comme le HIV-1 (SIDA).
Pourquoi la descendance de LADI est-elle relativement peu nombreuse ?
Si malgré toute la valeur de ce type d'instruments il y a peu de diffractomètres de type LADI dans le monde, c'est essentiellement dû à la grande rareté des sources de neutrons suffisamment intenses pour que la biologie structurale puisse y être pratiquée. En effet, s'il est "facile" de construire un synchrotron puissant, en revanche, construire une source de neutrons intense est difficile, et le qualificatif de "intense", dans ce cas, reste très relatif, comme expliqué plus haut.

- A gauche : L'instrument VIVALDI de l'Institut Laue-Langevin, ©2003 ILL, Grenoble, France
- A droite : L'instrument LADI III en fonctionnement à l'Institut Laue-Langevin, ©2020 ILL, Grenoble, France.
---
NOTES :
[1] EMBL : European Molecular, Biology, Laboratory; ILL : Institut Laue-Langevin. Tous deux situés sur l'EPN Campus de Grenoble.
[2] "A large image-plate detector for neutrons", Cipriani F., Castagna J.C., Lehmann M.S. and Wilkinson C. (1995) Physica B, 213-214, 975-977. https://doi.org/10.1016/0921-4526(95)00340-F




