Les nitrates dans l’environnement
Publié par Encyclopédie Environnement, le 20 octobre 2020 10k
Agriculture et fuites de nitrates dans l’environnement
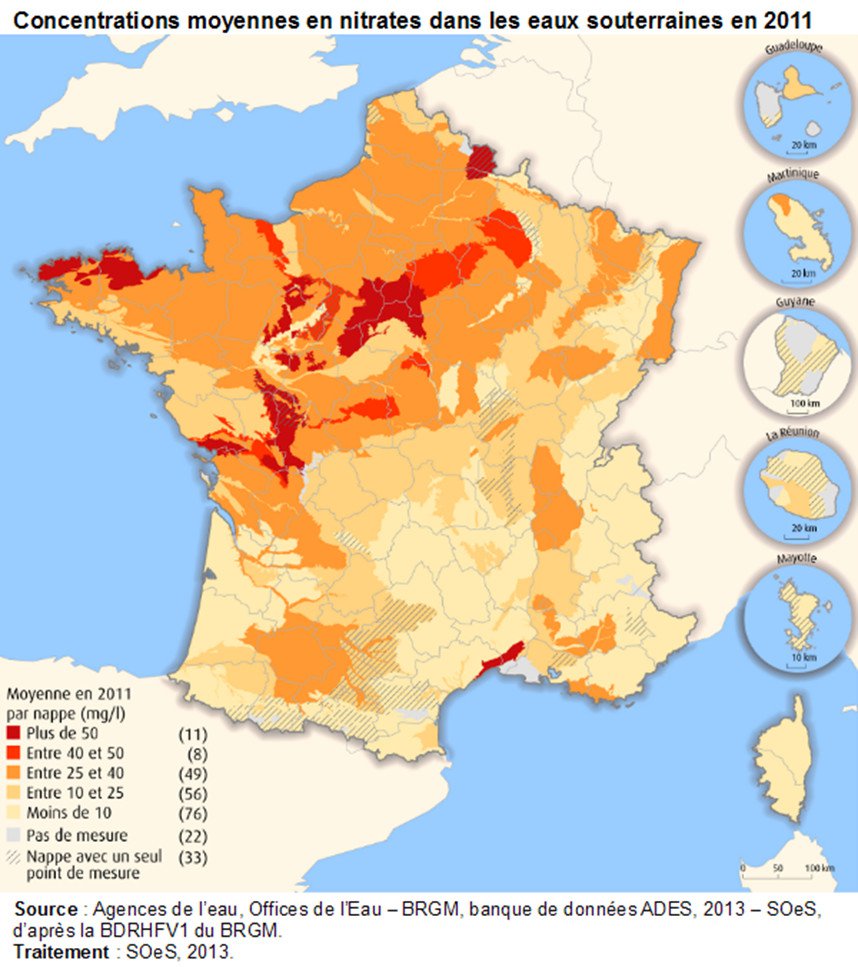
Au cours de la seconde moitié du 20e siècle, l’agriculture a été marquée par une intensification de ses modes de production basée notamment sur le développement de l’usage des fertilisants azotés. Cela s’est accompagné d’une accentuation de la contamination des eaux continentales par les nitrates, réalité maintenant bien établie. En France, les zones d’agriculture intensive présentant les plus fortes contaminations se trouvent dans la moitié Nord-Ouest de la France, une partie du Sud-Ouest et de la vallée du Rhône et la plaine d’Alsace (Figure 1).

D’où proviennent les nitrates du sol et des eaux ?
La présence de nitrates dans le sol et les eaux est la résultante de l’ensemble des transformations liées au cycle de l’azote qui se déroule naturellement dans l’environnement (Figure 2) sous l’action d’un réseau complexe de microorganismes.

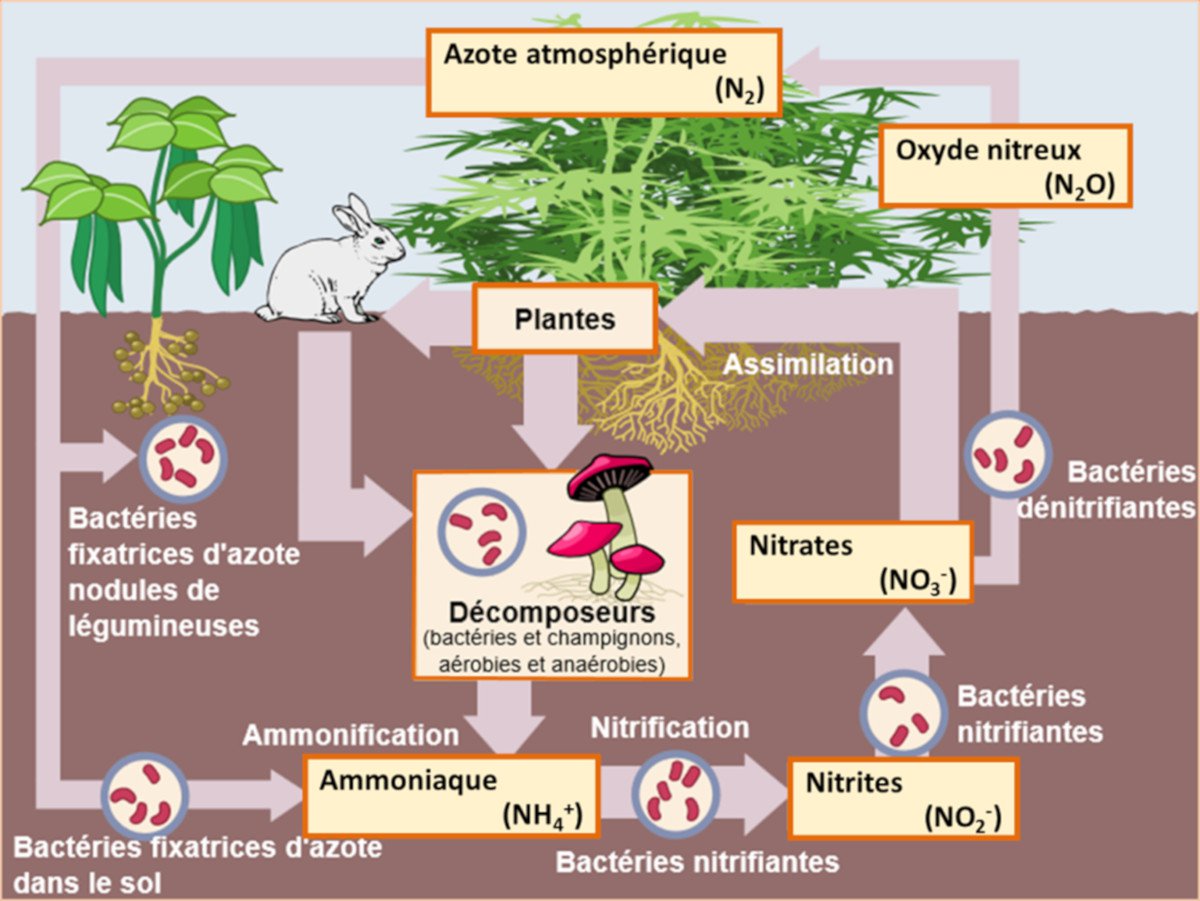
Parmi ces microorganismes, un ensemble de populations bactériennes sont capables de transformer l’azote gazeux de l’atmosphère en azote ammoniacal, utilisable par les plantes, notamment les légumineuses associées à certaines bactéries spécifiques. L’azote absorbé par les plantes permet en particulier la synthèse de leurs protéines et d’autres produits organiques utilisés en alimentation animale ou humaine.
Lors de la décomposition des produits végétaux ou animaux dans le sol, l’azote organique qu’ils renferment est à nouveau transformé en azote ammoniacal. Il peut être utilisé à nouveau par les plantes ou va être transformé par la nitrification en nitrites puis en nitrates. En milieu pauvre en oxygène, ces nitrates subissent une dénitrification par certaines bactéries du sol qui les transforment en nitrites puis finalement en diazote atmosphérique inerte (N2), revenant ainsi au point de départ du cycle.
Dans les milieux naturels, la concentration en nitrates du sol ou des eaux est en général faible, les concentrations en nitrates peuvent être plus importantes dans les milieux enrichis en matières organiques, naturellement ou sous l’action de l’homme. Ainsi les accumulations de guano au Chili ont été une source de nitrates naturels utilisés en agriculture, remplacés par des fertilisants industriels après la mise au point du procédé Haber-Bosch.
L’utilisation à grande échelle de fertilisants azotés a eu un effet incontestable sur l’accroissement des rendements des plantes cultivées. Mais ces apports d’éléments fertilisants ont eu aussi pour conséquence l’accentuation de fuites de nitrates dans l’environnement.
Les nitrates de l’eau sont-ils dangereux pour la santé ?
La grande solubilité des nitrates favorise leur diffusion du sol vers les nappes souterraines ou les rivières en période de pluie abondante. Leur présence dans notre milieu vivant est donc naturelle. Nous consommons régulièrement des nitrates, généralement à faible dose. Ils sont apportés par les légumes et les fruits, par l’eau, voire par des produits enrichis en nitrates ou en nitrites utilisés comme agents de conservation des aliments.
L’augmentation des teneurs en nitrates dans les eaux fluviales et souterraines a été à l’origine d’interrogations sur leur toxicité. L’Organisation Mondiale de la Santé (OMS) a ainsi été amenée à définir une dose journalière admissible (DJA) de nitrates dans l’alimentation en fonction du poids de la personne : 3,7 mg NO3–/kg/jour, généralement ramené à 250 mg/jour pour une personne pesant 70 kg.
L’absorption de nitrates, à faible dose, est considérée par certains comme bénéfique pour la santé. Cependant l’attention des autorités sanitaires a porté principalement sur deux risques identifiés consécutifs à une telle absorption :
C’est la raison du suivi permanent des teneurs en nitrates des réseaux de distribution d’eau préconisé par l’OMS. Les observations épidémiologiques ont conduit l’OMS à définir une norme de concentration maximale acceptable de nitrates dans l’eau potable (50 mg/l) principalement basée sur le risque de la méthémoglobinémie des nourrissons.
Impact des nitrates sur l’environnement
Nitrates et eutrophisation des milieux aquatiques. Les eaux de surface (rivières et milieux lacustres) et les eaux des littoraux marins peuvent être enrichies par les fuites d’azote minéral. Ces fuites sont la conséquence des apports en excès de nutriments azotés, souvent accompagnés de phosphore, dans les rejets en rivière d’eaux résiduaires domestiques ou de fuites d’effluents animaux (fumier, lisier) épandus sur les champs.
Ce processus favorise la prolifération d’une biomasse végétale dans l’eau et l’eutrophisation des lacs (Figure 3). L’augmentation du volume d’algues en surface va provoquer une chute de l’apport lumineux au niveau des eaux plus profondes et ainsi l’arrêt de la photosynthèse nécessaire à la production d’oxygène conduisant à la mort de l’écosystème. La biomasse végétale en décomposition entraîne une consommation d’oxygène aux dépens de la faune aquatique. Elle crée des conditions de putréfaction avec production de composés parfois toxiques, notamment de sulfure d’hydrogène.

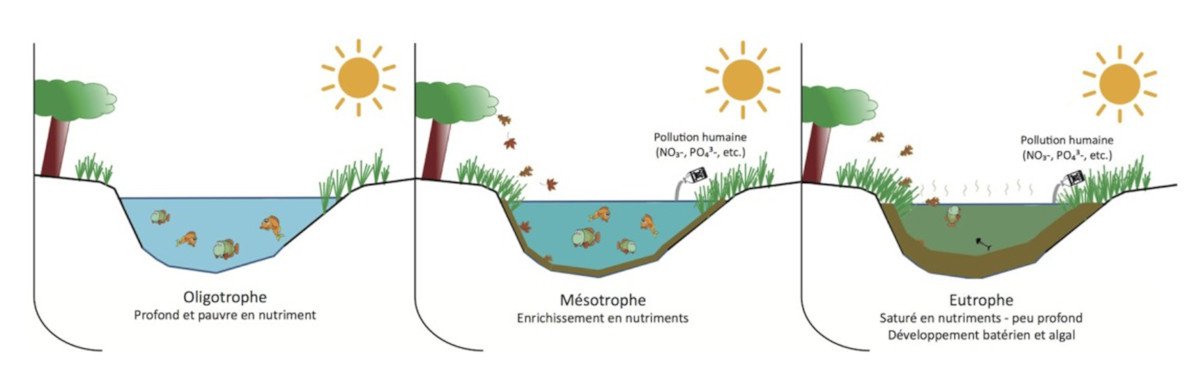
Ainsi dans les lacs de montagne, les phénomènes d’eutrophisation ont été induits par les apports de phosphates dus aux rejets d’effluents domestiques. Ces phosphates ont permis le développement de cyanobactéries, microorganismes doués à la fois de photosynthèse et de capacité à fixer l’azote de l’air pour la synthèse de leurs protéines. Ces phénomènes d’eutrophisation dans les lacs alpins ont été maîtrisés (lac d’Annecy) ou ont sensiblement régressé sous l’effet de la réduction des pollutions phosphatées (Lac Léman, lac du Bourget…).
Par contre la prolifération algale et ses conséquences putrides sont particulièrement spectaculaires dans les zones côtières bretonnes et sont principalement liées aux transferts de nitrates consécutifs aux excès d’épandages d’effluents d’élevage. Le principal moyen de limiter leur prolifération observée au printemps réside dans la diminution de la disponibilité en nitrates.
Nitrates du sol et émissions d’oxydes d’azote. Au cours des transformations dues aux bactéries de la dénitrification en milieu pauvre en oxygène, de l’oxyde nitrique (NO) et de l’oxyde nitreux (N2O) peuvent être émis. Or ces deux gaz sont des polluants atmosphériques :
- L’oxyde nitrique est un précurseur de l’ozone néfaste pour la végétation dans les basses couches de l’atmosphère. Ces émissions sont relativement de faible importance par rapport aux autres sources anthropiques, notamment celles dues aux véhicules.
- L’oxyde nitreux est, par contre, un puissant gaz à effet de serre : 1000 fois moins concentré que le gaz carbonique, mais avec un potentiel de réchauffement global 300 fois plus fort, il contribue pour 7,5 % à l’accroissement de l’effet de serre. La dénitrification des sols agricoles constituent la principale source naturelle de ce gaz dont l’augmentation de concentration dans l’atmosphère est en relation directe avec le développement des fertilisants azotés.
Limiter ces émissions constitue l’un des enjeux actuels de la gestion de l’azote en agriculture, en cherchant notamment à limiter la disponibilité en nitrates dans les périodes où les plantes n’en ont pas de besoin.
Les nitrates et la destruction de la matière organique du sol. Lorsque les nitrates du sol sont inutilisés par les plantes, ils finissent par être dénitrifiés et l’azote retourne à plus ou moins long terme à l’atmosphère. Or cette réaction est couplée à l’oxydation de la matière organique du sol et à la consommation du carbone stocké dans le sol.
Ainsi, l’apport au sol de 100 kg/ha d’azote sous forme nitrique constitue une capacité d’oxydation (et donc d’élimination) d’une quantité équivalente (107 kg/ha) de carbone organique du sol par ce mécanisme de dénitrification.
Comment réduire les fuites d’azote dans l’environnement ?
Confrontée à la nécessité de réduire les concentrations en nitrates des eaux des captages destinées à l’alimentation la France a été condamnée en septembre 2014 par la cour de Justice de l’Union Européenne pour sa gestion laxiste des pollutions azotées par l’agriculture. Cela l’a conduit en particulier à engager un réexamen des modes de calculs élaborés avec la profession agricole pour définir les doses de fertilisants azotés utilisées afin de se mettre en conformité avec la réglementation européenne sur la qualité des eaux.
Les agriculteurs doivent définir les apports d’azote aux cultures avant que celles-ci se développent. L’une de leurs difficultés réside dans cette évaluation a priori des besoins azotés et dans les pratiques à mettre en œuvre pour que la disponibilité en azote soit en phase avec les besoins de la végétation. Les quantités à apporter doivent prendre en compte les disponibilités en azote de différentes sources auxquelles les plantes ont accès (humus, résidus organiques apportés au sol comme les fumiers). Cela implique des ajustements plus précis des apports en cas de déficit nutritionnel avéré.
On assiste ainsi à un développement de travaux visant à comparer différents modes de production et faire émerger des pratiques de fertilisation azotée plus intégrées et moins génératrices de pollutions.
-
Ce texte est essentiellement tiré de l’article « Les nitrates dans l’environnement » de Jean-Claude Germon, Directeur honoraire de recherche à l’INREA, Membre de l’Académie d’Agriculture.
Les lecteurs sont invités à lire les articles de l’Encyclopédie de l’Environnement traitant de thèmes directement associés à ce sujet :
- Nourrir les plantes en polluant moins
- Des plantes qui vivent de l’air du temps
- Quel est l’impact des polluants de l’air sur la végétation ?
- Symbiose et parasitisme
- Phosphore et eutrophisation
- Le droit de l’eau en France
Ce travail a été réalisé grâce au soutien financier d'UGA Éditions dans le cadre du programme "Investissement d'avenir", et de la Région Auvergne Rhône-Alpes.
- Retrouvez-nous sur notre site internet encyclopedie-environnement.org
- Retrouvez-nous également sur Facebook, Twitter et LinkedIn




