Quelle heure est-il à mon horloge épigénétique ?
Publié par Encyclopédie Environnement, le 16 décembre 2019 6.3k
Pour quelle raison des jumeaux issus du même œuf, ayant le même génome, (on dit qu’ils ont le même génotype) présentent-ils des différences au niveau de leur apparence (qu’on appelle le phénotype : apparence et constitution physique, manifestation spécifique d'un trait…) ? Comment une seule cellule, l'ovule fécondée, peut-elle donner des centaines de types de cellules différentes (comme les neurones, les cellules musculaires, ou les cellules glandulaires…), avec chacune un rôle spécialisé, et ce, bien que l’information contenue dans l’ADN soit identique dans chacune de ces cellules ? Qu’est-ce qui différencie la reine, les faux-bourdons et les ouvrières chez les abeilles ?
Tout ceci relève de « l’épigénétique »
Ce mot signifie « les éléments ajoutés par-dessus la génétique ». Dans le cas des vrais jumeaux, avec des patrimoines génétiques identiques, ceux-ci peuvent évoluer différemment dans leurs environnements respectifs (alimentation, maladies, médicaments et toxiques, stress, lieu & hygiène de vie). Les mécanismes épigénétiques permettent au génome de moduler son fonctionnement, sans modifier l’information contenue dans les gènes eux-mêmes et les changements d’activité des gènes seront transmis au fil des divisions cellulaires (voire au fil des générations) sans faire appel à des mutations de l’ADN (voir notre article Le génome, entre stabilité et variabilité). L’épigénétique est une sorte de « mémoire de l’activité des gènes », elle se fonde sur des « marques épigénétiques » (comme la méthylation de l’ADN). Ainsi l’identité cellulaire est acquise et conservée grâce aux marques épigénétiques.
La question de la transmission transgénérationnelle de ces marques épigénétiques est très documentée chez les plantes mais fait encore l’objet de controverses chez les mammifères (voir notre article L'épigénétique, le génome et son environnement).
Des déséquilibres épigénétiques précoces dans le développement fœtal
Alors que le génome est très figé, l’épigénome est bien plus dynamique. Ainsi chez la plupart des organismes vivants, les modifications épigénétiques permettraient aux individus d’explorer rapidement une adaptation à une modification de l’environnement. Cependant les données s’accumulent pour démontrer que les facteurs épigénétiques pourraient être impliqués dans la prévalence des maladies chroniques (78 % des adultes de plus de 55 ans sont touchés par celles-ci https://www.cdc.gov/chronicdisease/index.htm). Une approche de la recherche médicale met l'accent sur le rôle de l'exposition prénatale et périnatale aux facteurs environnementaux (figure 1). Le fœtus serait porteur de marques épigénétiques induites par son environnement précoce. Cependant ce mécanisme adaptatif se révèlerait désavantageux si les conditions environnementales se modifient. L’étude d’une cohorte d’individus conçus lors de la famine de 1944-45 en Hollande confirme cette hypothèse (voir notre article Épigénétique : comment l'environnement influence nos gènes). Des études épidémiologiques réalisées dans une petite ville située au-delà du cercle polaire en Suède, montrent que les habitants sont plus susceptibles de développer un diabète ou des maladies cardiovasculaires si leurs ancêtres ont subi des déséquilibres nutritionnels. C’est ce qu’on appelle le syndrome métabolique. [1]
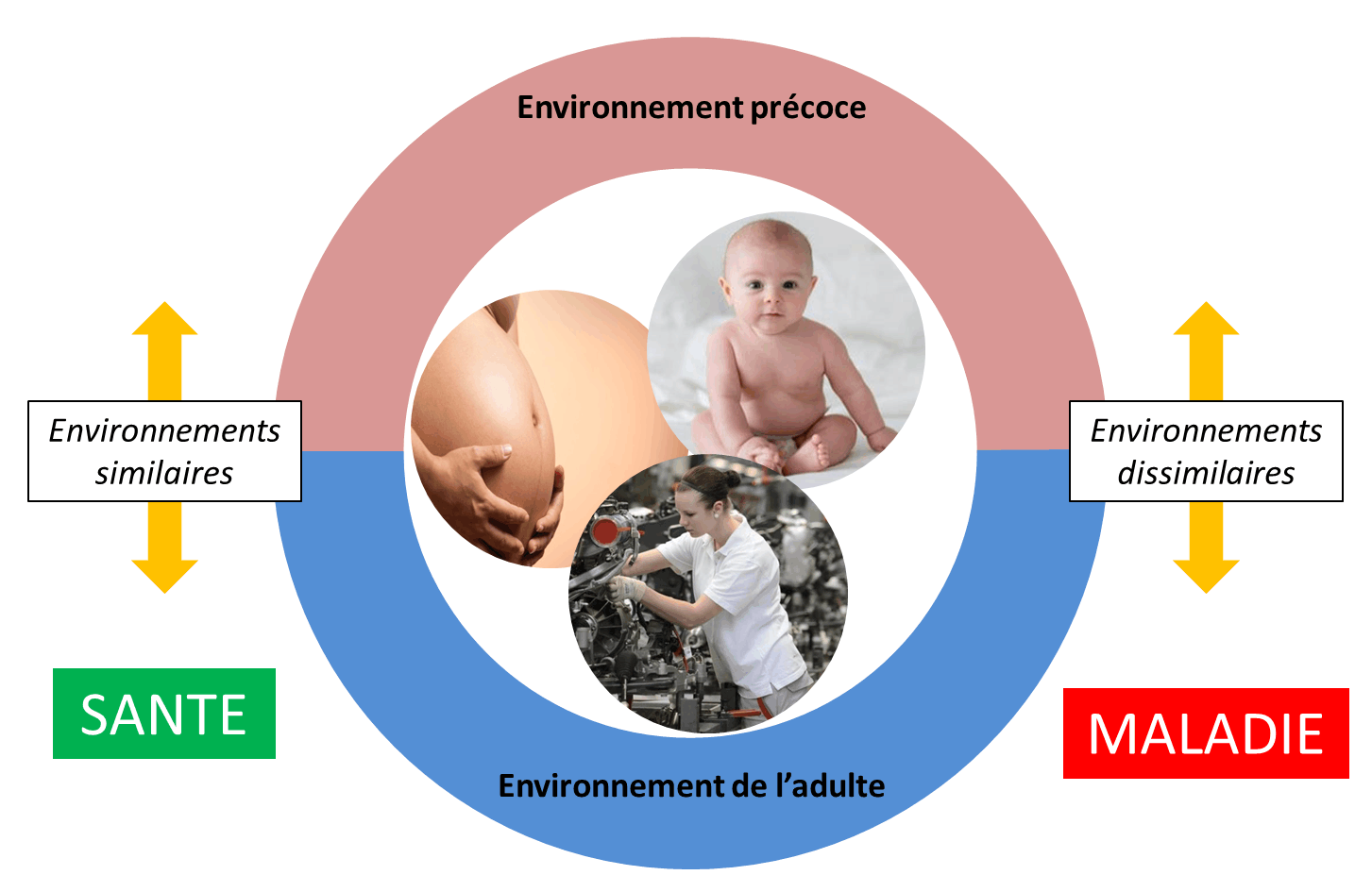
D’autres facteurs comme l’environnement psychosocial de l’enfant ou son exposition à des maltraitances pourraient être des facteurs déterminants pour l’état de santé psychique et physique à un âge adulte. Chez le rat, la mère materne soigneusement ses petits (préparation du nid, position lors de l’allaitement entre autres). Ce soin est crucial pour la maturité des fonctions cérébrales et l’adaptation comportementale vis-à-vis d’un stress chez les descendants. Le faible maternage conduit à une augmentation de la méthylation de l’ADN dans le promoteur des récepteurs aux glucocorticoïdes entraînant une diminution de l’expression de ces gènes dans une zone du cerveau impliquée dans l'acquisition de la mémoire, l’hippocampe (voir notre article Épigénétique : comment l'environnement influence nos gènes).
De manière plus globale, les apports nutritionnels, le mode de vie et l’environnement psychosocial des parents semblent affecter l’expression des gènes de la machinerie épigénétique au cours de la formation des cellules reproductrices et du développement embryonnaire. Des travaux récents soulignent les risques sanitaires liés à l’exposition du fœtus à de nombreux perturbateurs endocriniens (d’origine naturelle – phytooestrogènes - ou d’origine industrielle, incluant le bisphénol A). Ces molécules interfèrent au moment du développement avec l’action des hormones, et notamment de l’hormone thyroïdienne, cruciale pour le développement du cerveau, via des mécanismes épigénétiques, entraînant des impacts sur la cognition mais aussi sur la différentiation sexuelle et sur la reproduction. Cette pollution aurait donc un coût sociétal très élevé, d’autant plus si certains effets délétères se transmettaient à la descendance via des marques épigénétiques.
Le concept de l’horloge épigénétique
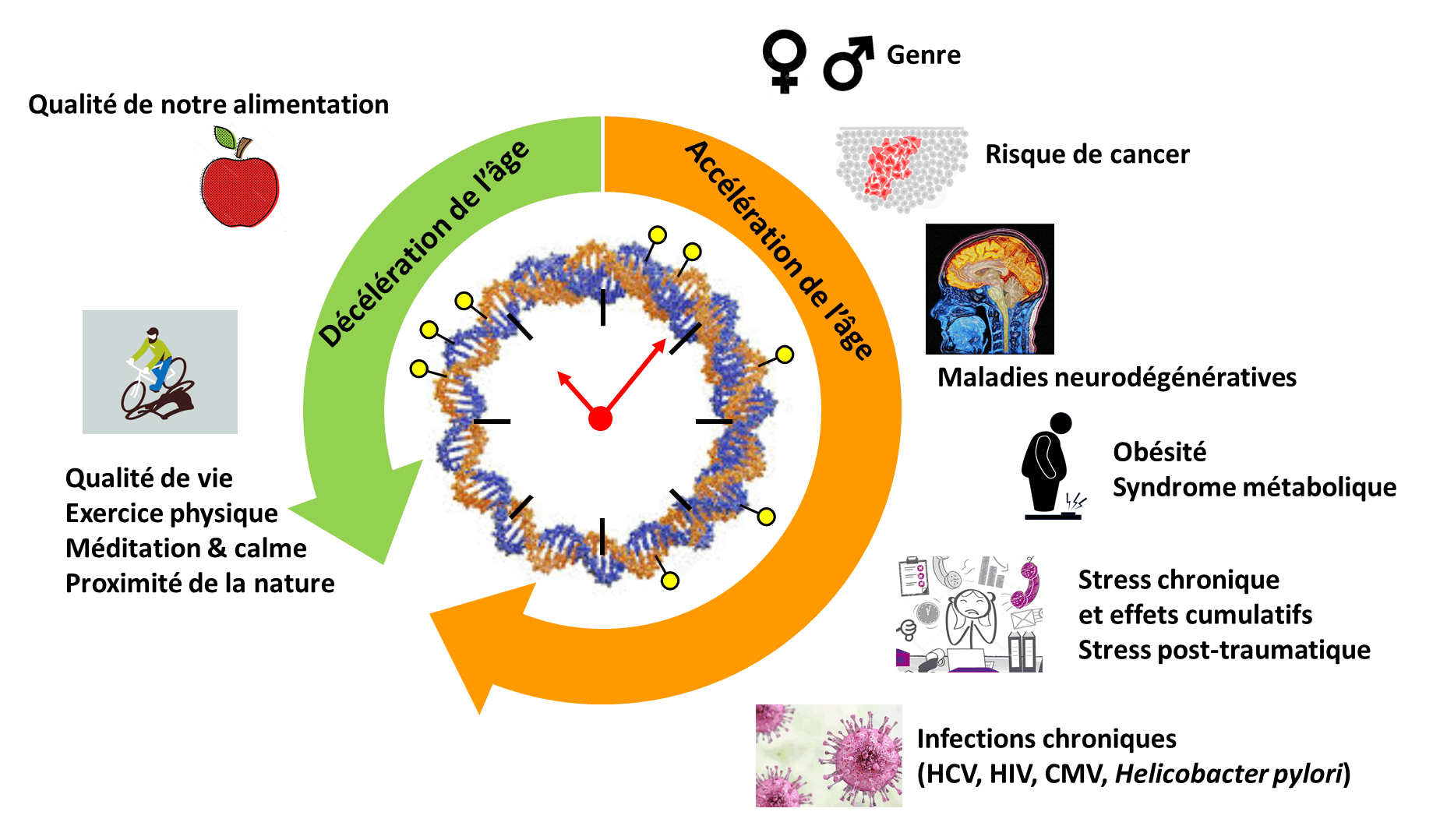
L’épigénome fournit également une mesure particulièrement prédictive de son état de santé actuel et futur. En effet, celui-ci évolue au cours de la vie de l’individu, c’est ce que l’on appelle l’horloge épigénétique (Figure 2). Ainsi, certains sites se méthylent de plus en plus avec les années, d’autres se déméthylent de plus en plus. A partir des profils de méthylation, il est possible de prédire l’âge de l’individu. Cet âge est appelé âge épigénétique. Le rythme de cette horloge est variable selon les individus. Chez certains individus cet âge est plus élevé que leur âge chronologique. L’horloge épigénétique de certains individus est accélérée en comparaison aux autres, ce qui est associé à un risque accru de maladies chroniques et de mortalité (Horvath et Raj, 2018). On ne sait pas encore si cette horloge épigénétique est une cause ou une conséquence du vieillissement. En revanche, sa précision et son pouvoir prédictif de l’état de santé de l’individu offrent la possibilité d’évaluer précisément l’efficacité d’interventions sur le mode de vie. Il a ainsi été montré que l’alimentation et l’exercice physique pouvaient ralentir cette horloge épigénétique. L’exposition au stress psychologique chronique accélère cette horloge, tandis qu’une étude préliminaire suggère que la pratique quotidienne de techniques de gestion du stress pourrait la ralentir.
Les enjeux de la recherche en épigénétique
Comprendre la participation des composantes non-génétiques à l’héritabilité des phénotypes constitue un enjeu majeur en sciences biologiques. S’ajoutent des enjeux d’ordre médicaux, thérapeutiques et sociétaux.
Enjeux médicaux, thérapeutique et sociétaux. Le concept ancien que les maladies complexes sont héritables, c’est-à-dire qu’elles réapparaissent fréquemment au sein des mêmes lignées familiales semble avoir un fondement de plus en plus solide. Pourtant, on peine à identifier les déterminants génétiques de ces maladies. Il est probable que les facteurs épigénétiques soient l’une des causes de cette héritabilité dite « manquante ». En outre, les parents tendent à transmettre à leurs enfants leur « niche » écologique et culturelle, ce qui peut ré-initier à chaque génération les mêmes profils épigénétiques, et potentiellement les mêmes risques de maladies complexes. Un des enjeux est donc d’établir s’il est possible de réguler, voire d’effacer, les marques épigénétiques potentiellement délétères pour la santé de l’individu. C’est le cas lorsque le fœtus est à risque, par exemple en cas d’exposition précoce à une sous-nutrition, à l’alcool (drogues en général) ou à un stress psychologique sévère.
Les voies thérapeutiques évoquées ci-dessus soulignent la potentielle réversibilité de l’épigénome via des approches pharmacologiques ou des interventions de mode de vie. Cependant, ces études sont encore préliminaires et la part de l’épigénome qui peut en effet répondre à ces interventions reste à déterminer.

Implications sociales. Au lieu d’une vision des populations humaines selon laquelle leurs différences biologiques sont déterminées par leur ADN, il apparaît que les facteurs écologiques, sociaux, économiques, culturels pourraient, en s’inscrivant dans le biologique via des mécanismes épigénétiques, être à l’origine de ces différences. Les travaux en épigénétique montrent que ce processus ne se fait pas seulement à l’échelle des populations sur le temps long de l’évolution darwinienne, mais se fait également à chaque naissance, sur le temps court du développement, sous l’influence des disparités environnementales auxquelles les individus font face.
--
[1] Le syndrome métabolique n’est pas une maladie en soi. Il désigne plutôt la présence d’un ensemble de signes physiologiques qui accroissent le risque de diabète de type 2, de maladies cardiaques et d’accident vasculaire cérébral (AVC).
--
Pour en savoir plus :
- Edith Heard ou la révolution épigénétique. Le journal du CNRS (Septembre 2018)
- Farooq A. (2010) Epigenetics: Tales of adversity. Nature 468, page S20
- Carey N. (2012) The epigenetics revolution. How modern biology is rewriting our understanding of genetics, disease, and inheritance. Columbia University Press. New-York
- Horvath S. & Raj K. (2018) DNA methylation-based biomarkers and the epigenetic clock theory of ageing. Nat Rev Genet 19:371-384
--
Ce billet a été proposé par Emmanuel Drouet, Professeur à l’Université Grenoble-Alpes (UGA), Institut de Biologie Structurale (IBS), co-éditeur de l'Encyclopédie de l'Environnement.
--
Ce travail a été réalisé grâce au soutien financier d'UGA Éditions dans le cadre du programme "Investissement d'avenir", géré par l'Agence nationale de la Recherche.
- Retrouvez-nous sur notre site internet encyclopedie-environnement.org
- Retrouvez-nous également sur notre page Facebook




